ANNEXE 1 : ORBITALES ATOMIQUES
L'électron n'est pas localisé au sens ponctuel du terme mais on peut décrire des régions de l'espace où cet électron a une forte probabilité de se trouver : c'est l'orbitale atomique.
- L'orbitale s est sphérique (l = 0),
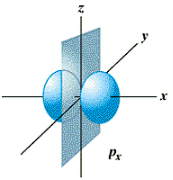
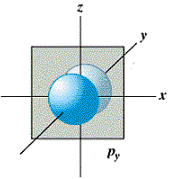
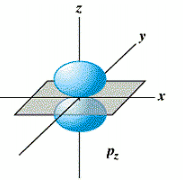
- L'orbitale p (l = 1) est formée de 2 lobes centrés sur un axe commun. Il y a 3 orbitales p (m = -1, 0, +1), px suivant l'axe des x, py suivant l'axe des y et pz suivant l'axe des z,



orbitale px orbitale py orbitale pz
- La forme des orbitales d (l = 2) est plus compliquée et il y a 5 orbitales d (m = -2, -1, 0, 1, 2):
Trois orbitales d comportent 4 lobes qui se développent dans les plans bissecteurs des quadrants: (dxy, dxz, dyz).
Les deux autres orbitales d sont centrées sur les axes :
dx2-y2 suivant les axes x et y,
dz2 a 2 lobes centrés sur l'axe z et possède un petit volume torique dans le plan xOy.

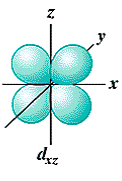
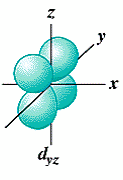
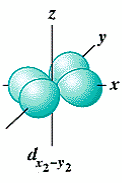

orbitale dxy orbitale dxz orbitale dyz orbitale dx²-y² orbitale dz²
ANNEXE 2 : TABLEAU PERIODIQUE DES ELEMENTS
